පදාර්ථයේ වෙනස් වීම්
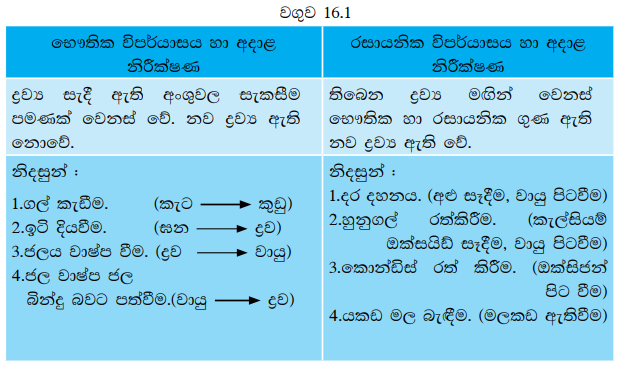
යකඩවලින් නිර්මිත භාණ්ඩ වාතයට නිරාවරණය කළ විට මල බැඳේ. කපුරු බෝල වාතයට නිරාවරණය කර තැබූ විට ප්රමාණයෙන් කුඩා වේ. අයිස් දිය වී ද්රව ජලය බවට පත් වේ. පදාර්ථවල සිදු වන මෙවැනි විවිධ වෙනස්වීම් අපි දැක ඇත්තෙමු. ඒවා පිළිබඳ ව තව දුරටත් කරුණු අධ්යයනය කරනු පිණිස 16.1 ක්රියාකාරකමෙහි නිරත වෙමු.
ඉහත ක්රියාකාරකම්වල නියැලීමෙන් ඔබ ලබාගත් නීරීක්ෂණ පහත සඳහන් නිරීක්ෂණ සමග ගැළපේ දැයි බලන්න.
- කපුරු බෝලය ද්රව වී වාෂ්ප බවට පත් වේ. වසන ලද හැන්දේ ඇතුළු පැත්තේ සුදු පැහැති කුඩක් බැඳී තිබුණි.
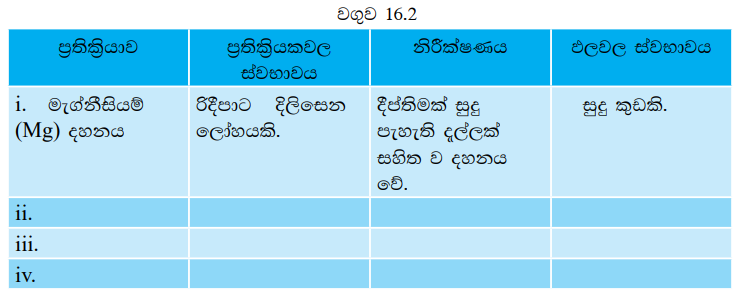
- මැග්නීසියම් (Mg) පටි දීප්තිමත් සුදු පැහැති දැල්ලක් සහිතව දැවී සුදු කුඩක් ඉතිරි විය.
- සෝඩියම් හයිඩ්රොක්සයිඩ් (NaOH) දිය විය. බීකරය රත් විය. උෂ්ණත්වමාන පාඨාංකය ඉහළ නැග ඇත.
- මැග්නීසියම් (Mg) පටි කැබැල්ල දිය වෙමින් වායු බුබුඑ නිකුත් විය. බීකරය රත් විය.
ඉහත 16.1 ක්රියාකාරකමේ (i) අවස්ථාවේ, දී ඝන කපුරු ද්රව වී පසුව වාෂ්පයක් බවට පත්වේ.
වසනලද හැන්දේ සිසිල් පෘෂ්ඨය මත දී වාෂ්පය නැවත ඝනීභවනය වී තුනී ඝන කපුරු ස්ථරයක් සෑදේ. මෙහි දී ඝන කපුරු ද්රව වන විටත්, ද්රව කපුරු වාෂ්ප බවට පත්වනවිටත්, කපුරු වාෂ්ප නැවත ඝන කපුරු බවට පත්වනවිටත් තිබෙන ද්රව්ය වෙනස් නොවී එහි භෞතික අවස්ථාව (අංශුවල සැකැස්ම) පමණක් වෙනස් වී ඇත. එවැනි විපර්යාස භෞතික විපර්යාස ලෙස හැඳින්වේ.
අංක (ii) සිට (iv) දක්වා අවස්ථාවලදී තිබෙන ද්රව්ය වෙනස් වී නව ද්රව්ය සෑදී ඇත. එවැනි විපර්යාස රසායනික විපර්යාස හෙවත් රසායනික ප්රතික්රියා ලෙස හැඳින්වේ.
රසායනික විපර්යාසයක් සිදු වී ඇති බව තහවුරු කරන සාක්ෂි ලෙස, දැල්ලක් සහිත ව දැවීම, රත් වීම, වායු බුබුළුළු පිට වීම, වර්ණ විපර්යාසයක් ඇති වීම, අවක්ෂේප ඇති වීම වැනි නිරීක්ෂණ දැක්විය හැකි ය.
රසායනික හා භෞතික විපර්යාස පිළිබඳ තව දුරටත් සොයාබැලීම සඳහා 16.1 වගුව අධ්යයනය කරමු.
රසායනික විපර්යාස
රසායනික විපර්යාසයකදී,
● ද්රව්ය දෙකක් හෝ කිහිපයක් එකතු වී නව ද්රව්ය සෑදීම.
● එක් ද්රව්යයක්, ද්රව්ය දෙකක් හෝ වැඩි ගණනක් බවට පත්වීම.
● තිබෙන ද්රව්ය වෙනස් ආකාරයට සංවිධානය වෙමින් නව ද්රව්ය ඇතිවීම සිදුවිය හැකිය.
රසායනික විපර්යාසයකට සහභාගි වන ද්රව්ය ප්රතික්රියක ලෙසත් රසායනික විපර්යාසය මඟින් ඇති වන නව ද්රව්ය ඵල ලෙසත් හැඳින්වේ.
රසායනික ප්රතික්රියාවකදී සිදුවනුයේ ප්රතික්රියක ඵල බවට පත්වීමයි.
ප්රතික්රියක → ඵල
රසායනික විපර්යාසවල විවිධත්වය අධ්යයනය කරනු පිණිස 16.2 ක්රියාකාරකමෙහි නිරත වෙමු.
ඉහත රසායනික විපර්යාස ඇසුරෙන් 16.2 වගුව සම්පුර්ණ කරන්න.
රසායනික විපර්යාසයේ ස්වභාවය අනුව ඒවා වර්ග හතරකට බෙදිය හැකි ය. එම වර්ග හතර පහත දැක්වේ.
■ රසායනික සංයෝජන ප්රතික්රියා
■ රසායනික වියෝජන ප්රතික්රියා
■ ඒක විස්ථාපන ප්රතික්රියා
■ ද්විත්ව විස්ථාපන ප්රතික්රියා
රසායනික සංයෝජන ප්රතික්රියා
ක්රියාකාරකම 16.2 හි පළමු ප්රතික්රියාව සලකන්න. එහිදී මැග්නීසියම් වාතයේ ඇති ඔක්සිජන් වායුව සමඟ ප්රතික්රියා කිරීමෙන් මැග්නීසියම් ඔක්සයිඩ් සෑදේ.
මැග්නීසියම් + ඔක්සිජන් → මැග්නීසියම් ඔක්සයිඩ්
2Mg + O2 → 2MgO
මෙහි දී මූලද්රව්ය දෙකක් එකතු වී නව සංයෝගයක් සෑදී ඇත.
මූලද්රව්ය – මූලද්රව්ය හෝ මූලද්රව්ය සංයෝග හෝ සංයෝග – සංයෝග හෝ එකතු වී නව සංයෝගයක් සෑදීම රසායනික සංයෝජන ප්රතික්රියාවක් ලෙස හැඳින්වේ.
රසායනික සංයෝජන ප්රතික්රියා සඳහා තවත් නිදසුන් කිහිපයක් පහත දැක්වේ.
හයිඩ්රජන් + ක්ලෝරීන් → හයිඩ්රජන් ක්ලෝරයිඩ්
H2 + Cl2 → 2HCl
කාබන්ඩයොක්සයිඩ් + කාබන් → කාබන්මොනොක්සයිඩ්
CO2 + C → 2CO2
කැල්සියම් ඔක්සයිඩ් + ජලය කැල්සියම් → හයිඩ්රොක්සයිඩ්
CaO + H2O → Ca(OH)2
රසායනික සංයෝජන ප්රතික්රියා සඳහා පොදු ප්රතික්රියාව පහත දැක්වේ.
රසායනික වියෝජන ප්රතික්රියා
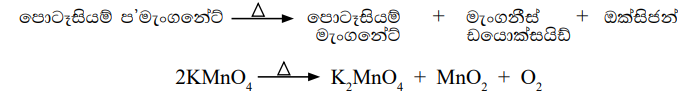
ක්රියාකාරකම 16.2 හි දෙවැනි ප්රතික්රියාව සලකන්න. එහිදී පොටෑසියම් ප’මැංගනේට් තාපය හමුවේ වියෝජනය වී වෙනත් සංයෝග හා මූලද්රව්ය සාදයි.
යම් සංයෝගයක් වියෝජනය වී වෙනත් සරල සංයෝග හෝ මූලද්රව්ය හෝ සංයෝග හා මූලද්රව්ය හෝ බවට පත්වීම රසායනික වියෝජන ප්රතික්රියාවක් ලෙස හැඳින්වේ.
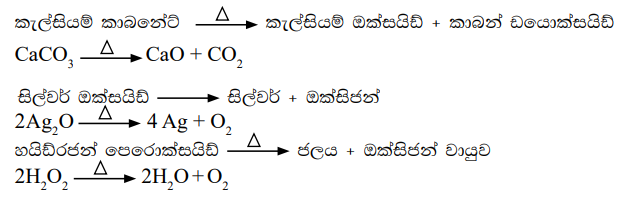
රසායනික වියෝජන ප්රතික්රියා සඳහා නිදසුන් කිහිපයක් පහත දැක්වේ.
රසායනික වියෝජන ප්රතික්රියා සඳහා පොදු ප්රතික්රියාව පහත දැක්වේ.
ඒක විස්ථාපන ප්රතික්රියා
ක්රියාකාරකම 16.2 හි තුන් වැනි ප්රතික්රියාව සලකන්න. එහි දී සින්ක් (Zn) ලෝහය කොපර් සල්ෆේට් සමඟ ප්රතික්රියා කර කොපර් (Cu) ලෝහය නිදහස් කරමින් සින්ක් සල්ෆේට් (ZnSO4) සාදයි.
සින්ක් + කොපර් සල්ෆේට් → සින්ක් සල්ෆේට් + කොපර්
Zn + CuSO4 → ZnSO4 + Cu
මූලද්රව්යයක්, යම් සංයෝගයක පවතින මූලද්රව්යයක් ඉන් විස්ථාපනය කරමින් ඊට හිමි ස්ථානය අත්කර ගෙන වෙනත් සංයෝගයක් සෑදීමේ ප්රතික්රියා ඒක විස්ථාපන ප්රතික්රියා නම් වේ.
ඒක විස්ථාපන ප්රතික්රියා සඳහා නිදසුන් කිහිපයක් පහත දැක්වේ.
මැග්නීසියම් + කොපර් සල්ෆේට් → මැග්නීසියම් සල්ෆේට් + කොපර්
Mg + CuSO4 → MgSO4 + Cu
මැග්නීසියම් + හයිඩ්රජන් ක්ලෝරයිඩ් → මැග්නීසියම් ක්ලෝරයිඩ් + හයිඩ්රජන්
2Mg + 2HCl → MgCl2 + H2
පොටෑසියම් බ්රෝමයිඩ් + ක්ලෝරීන් → පොටෑසියම් ක්ලෝරයිඩ් + බ්රෝමීන්
2KBr + Cl2 → 2KCl + Br2
ඒක විස්ථාපන ප්රතික්රියා සඳහා පොදු ප්රතික්රියාව මෙලෙස දැක්විය හැකිය.
ද්විත්ව විස්ථාපන ප්රතික්රියා
ක්රියාකාරකම 16.2 හි හතර වැනි ප්රතික්රියාව සලකන්න. මෙහිදී බේරියම් ක්ලෝරයිඩ් හා සෝඩියම් සල්ෆේට් ප්රතික්රියා කර බේරියම් සල්ෆේට් හා සෝඩියම් ක්ලෝරයිඩ් සෑදී ඇත.
බේරියම් ක්ලෝරයිඩ් + සෝඩියම් සල්ෆේට් → බේරියම් සල්ෆේට් + සෝඩියම් ක්ලෝරයිඩ්
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
යම් සංයෝගයක අඩංගු මූලද්රව්යයක් හෝ අයන ඛණ්ඩයක් හෝ වෙනත් සංයෝගයක අඩංගු මූලද්රව්යක් හෝ අයන ඛණ්ඩයක් සමග හුවමාරු වීමේ ප්රතික්රියාවක් ද්විත්ව විස්ථාපන ප්රතික්රියාවක් ලෙස හැඳින්වේ.
ද්විත්ව විස්ථාපන ප්රතික්රියා සඳහා තවත් නිදසුන් කිහිපයක් පහත දැක්වේ.
ෆෙරස් සල්ෆේට් + සෝඩියම් හයිඩ්රොක්සයිඩ් → ෆෙරස් හයිඩ්රොක්සයිඩ් + සෝඩියම් සල්ෆේට්
FeSO4 + 2NaOH → 2Fe(OH)2 + Na2SO4
කැල්සියම් ක්ලෝරයිඩ් + සෝඩියම් කාබනේට් → කැල්සියම් කාබනේට් + සෝඩියම් ක්ලෝරයිඩ්
CaCl2+Na2CO3 → CaCO3 + 2NaCl
ද්විත්ව විස්ථාපන ප්රතික්රියා සඳහා පොදු ප්රතික්රියාව පහත දැක්වේ.